近日,中国科学院微生物研究所王罗医团队在Nature Communications上发表题为“Genetic engineering of Sorangium cellulosum reveals hidden enzymology in myxobacterial natural product biosynthesis”的研究论文。该团队通过开发纤维堆囊菌的高效遗传操作体系,深入解析抗真菌活性化合物安布替星(ambruticin)的生物合成机制,揭示了其中多步此前未知的关键酶学反应。该研究为黏细菌天然产物资源的深度挖掘及其代谢工程改造提供了重要理论依据和技术支撑。
微生物来源的天然产物因其复杂多样的化学结构和显著的生物活性,长期以来是新药研发的重要资源库。目前,以真菌和放线菌为代表的传统药源微生物已得到广泛研究,并成功推动多个临床一线药物的研发与应用。黏细菌(myxobacteria)是一类分布广泛、具有多细胞社会学行为的革兰氏阴性细菌,也是迄今报道的基因组最大的原核生物,蕴藏着丰富且独特的天然产物生物合成基因簇,展现出巨大的药物开发潜能,其中来源于堆囊菌属(Sorangium)黏细菌的埃博霉素(epothilone)已成功应用于乳腺癌等多种癌症的临床治疗。然而,黏细菌培养困难、生长缓慢,遗传操作工具匮乏,严重限制了该类微生物中活性天然产物资源的系统挖掘与开发利用。
针对上述技术瓶颈,研究团队成功建立了一套高效的堆囊菌属黏细菌遗传操作体系,在多种以往难以进行遗传改造的菌株中实现了稳定、高效的基因操作,有效突破了传统方法效率低、适用范围窄且高度依赖菌株特异性的局限;基于该技术平台,团队进一步对堆囊菌来源的代表性化合物安布替星的生物合成机制开展了深入研究,揭示了环氧水解酶AmbK在六元氧杂环构建及聚酮合酶AmbH在聚酮骨架迭代延伸过程中的关键催化功能。该研究成果修正了领域内对该化合物生物合成路径长达近二十年的认知(图1),为后续代谢途径改造与衍生物开发奠定了重要理论基础。
中国科学院微生物研究所博士研究生钟晓彤和已毕业硕士研究生刘珊为论文共同第一作者,王罗医研究员与英国布里斯托大学Christine L. Willis教授为论文共同通讯作者。该研究得到国家重点研发计划、国家自然科学基金、北京市自然科学基金等项目的资助。
原文链接:https://www.nature.com/articles/s41467-025-63441-y
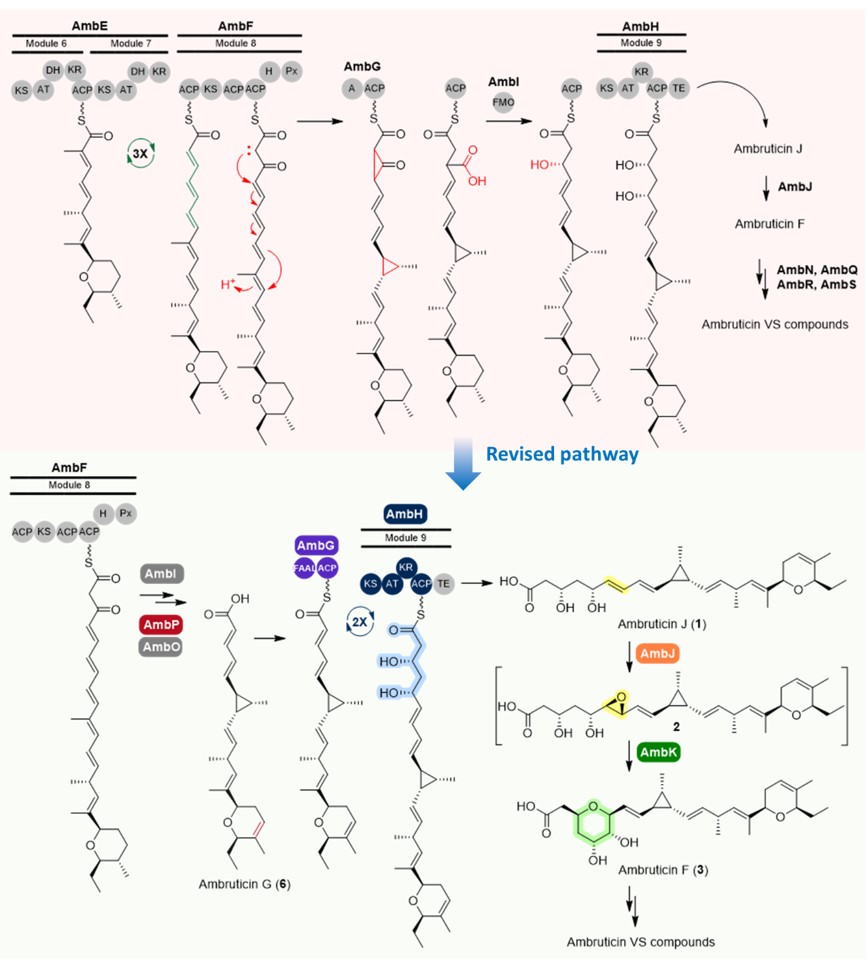
图1 安布替星生物合成途径




