近日,中国科学院微生物研究所刘翠华团队揭示了结核分枝杆菌(M. tuberculosis,Mtb)蛋白激酶PknG通过靶向宿主线性泛素链组装复合物(LUBAC),进而抑制炎症小体介导的胞质免疫监视的病原免疫逃逸新机制(图1),相关研究以“Pathogenic phosphorylation of linear ubiquitin machinery causes inflammasome sensor degradation”为题发表在Cell Reports上。
结核病(tuberculosis,TB)是由Mtb引起的一种重大慢性传染病,目前已重回全球感染性疾病致死之首。Mtb是一种极具适应性的胞内病原菌,与沙门氏菌、布鲁氏菌等需“藏身”于宿主细胞内特化囊泡中存活的病原菌不同,Mtb能够从胞内囊泡中逃逸至细胞质中存活,提示其拥有逃逸宿主胞质免疫监视的独特策略,但相关机制研究有限。
胞质免疫受体NLRP3是宿主胞内免疫监视系统的核心组件。当感知病原信号后,NLRP3可通过衔接蛋白ASC招募caspase-1进而组装形成炎症小体,最终介导细胞焦亡(pyroptosis)并释放IL-1β等炎性细胞因子。研究团队通过高通量筛选发现,Mtb分泌的蛋白激酶PknG是抑制NLRP3炎症小体组装的关键效应分子。进一步的机制研究表明,在感染过程中,Mtb PknG直接靶向并磷酸化宿主LUBAC复合物的HOIL-1L亚基进而介导了双重调控机制:一方面,HOIL-1L的磷酸化修饰阻碍了HOIL-1L与LUBAC催化亚基HOIP的结合,进而抑制LUBAC的形成及其介导的ASC线性泛素化修饰;另一方面,该磷酸化修饰还激活了HOIL-1L自身的E3泛素连接酶活性,进而促进HOIL-1L介导的NLRP3 K48泛素化修饰及降解。综上,PknG通过“一箭双雕”的调控机制,有效促进Mtb逃逸NLRP3介导的胞质免疫监视,增强其在宿主细胞内的存活能力与感染进程。
该研究揭示了Mtb通过“跨物种多酶级联反应”实现免疫逃逸的新策略:即利用自身蛋白激酶PknG活化宿主E3泛素连接酶HOIL-1L的活性,既破坏了线性泛素化机器LUBAC正常的免疫调控功能,又促进了胞质免疫传感器NLRP3的K48泛素化修饰与降解。这一发现提示,靶向PknG与HOIL-1L互作界面有望成为增强宿主保护性免疫应答并减轻病理性炎症损伤的TB防治新策略,为基于PknG靶点开发抗TB药物或优化卡介苗(BCG)提供了重要的理论依据。
中国科学院微生物研究所博士研究生于洋与首都医科大学附属胸科医院博士研究生余珊珊为论文共同第一作者,微生物所刘翠华研究员、柴琪瑶项目研究员及军事科学院军事医学研究院张令强研究员为论文共同通讯作者。研究得到广州国家实验室项目等资助。
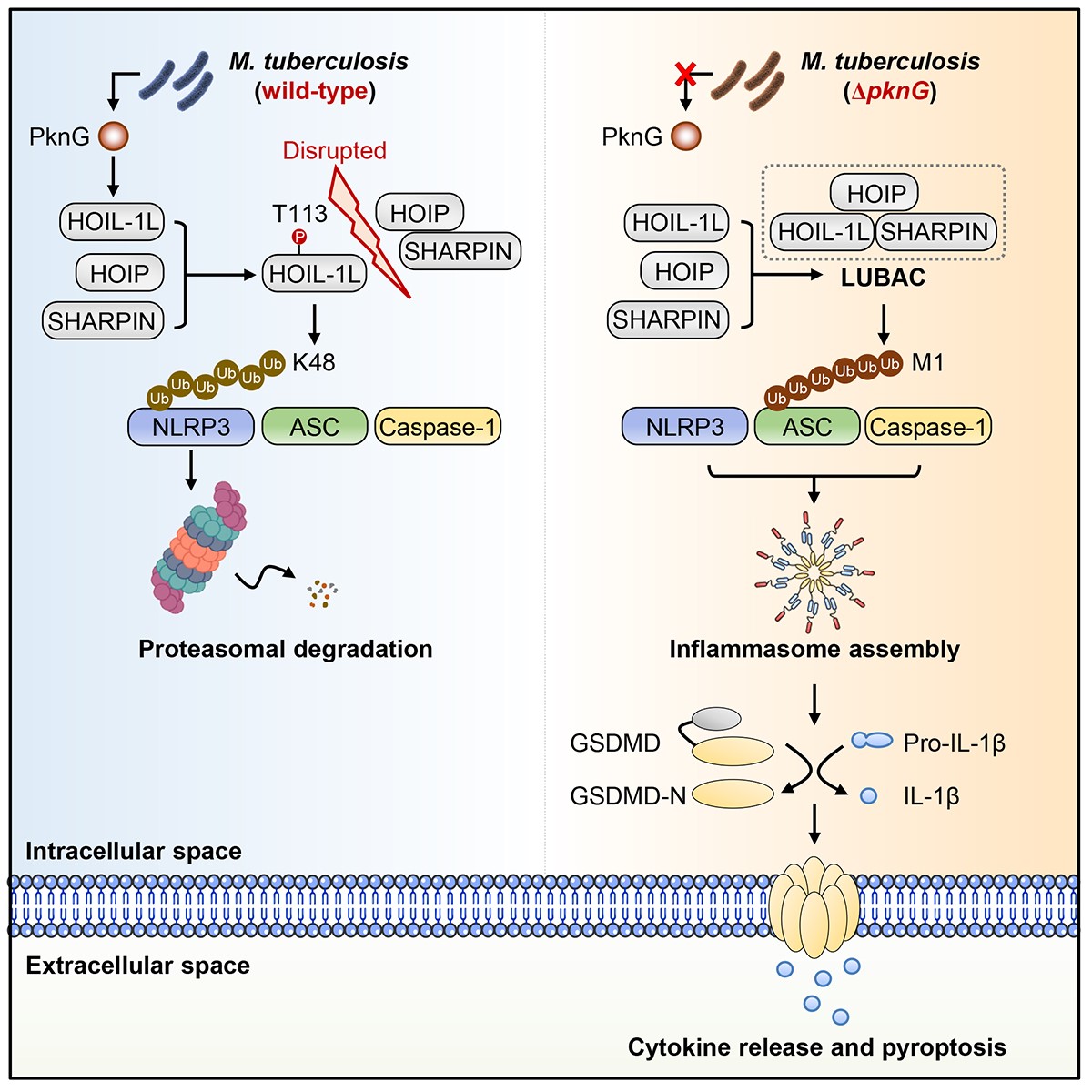
图1. Mtb PknG劫持宿主线性泛素化复合物(LUBAC)进而逃逸NLRP3炎症小体介导的胞质免疫监视
文章链接:https://doi.org/10.1016/j.celrep.2025.116286




