糖类不仅是细胞能量的主要来源,也是构成细胞结构的重要组成部分,其中,以己糖为代表的分子通过碳-碳键断裂生成短链化合物,是其进入代谢网络并执行生理功能的重要途径。在初级代谢中,己糖的裂解反应通常通过己酮糖的反向醛缩(retro-aldol)或类转酮(transketo-like)机制实现(图 1)。相比之下,在化学多样性极为丰富的次级代谢领域,己糖裂解反应却鲜有报道。
近年来,陈义华团队聚焦聚酮类天然产物环烯酸菌素(Aurantinins,ARTs)的生物合成机制研究,取得了一系列重要突破。团队揭示了一类广泛存在于不同细菌中、新颖的聚酮生物合成在线甲酯化起始机制;成功表征了一类可识别琥珀酰单元的新型酰基转移酶;发现了一类特殊的ECHQ结构域,该结构能够重塑聚酮类化合物ARTs的组装过程,进而产生新的ATAs类化合物。相关成果为深入理解聚酮化合物的生物合成机制及后续的理性改造奠定了坚实基础(Nature Communications, 2021; Organic Chemistry Frontier, 2022; Applied Microbiology and Biotechnology, 2023; Advanced Science, 2024)
近期,中国科学院微生物研究所陈义华团队、李德峰团队以及厦门大学王斌举团队合作,解析了一种在次级代谢产物环烯酸菌素生物合成中,可催化己糖碳-碳键氧化裂解的金属异构酶。相关研究成果以“Oxidative cleavage of hexopyranose by a TIM-barrel isomerase”为题,于9月24日在线发表在《自然-催化》(Nature Catalysis)上。
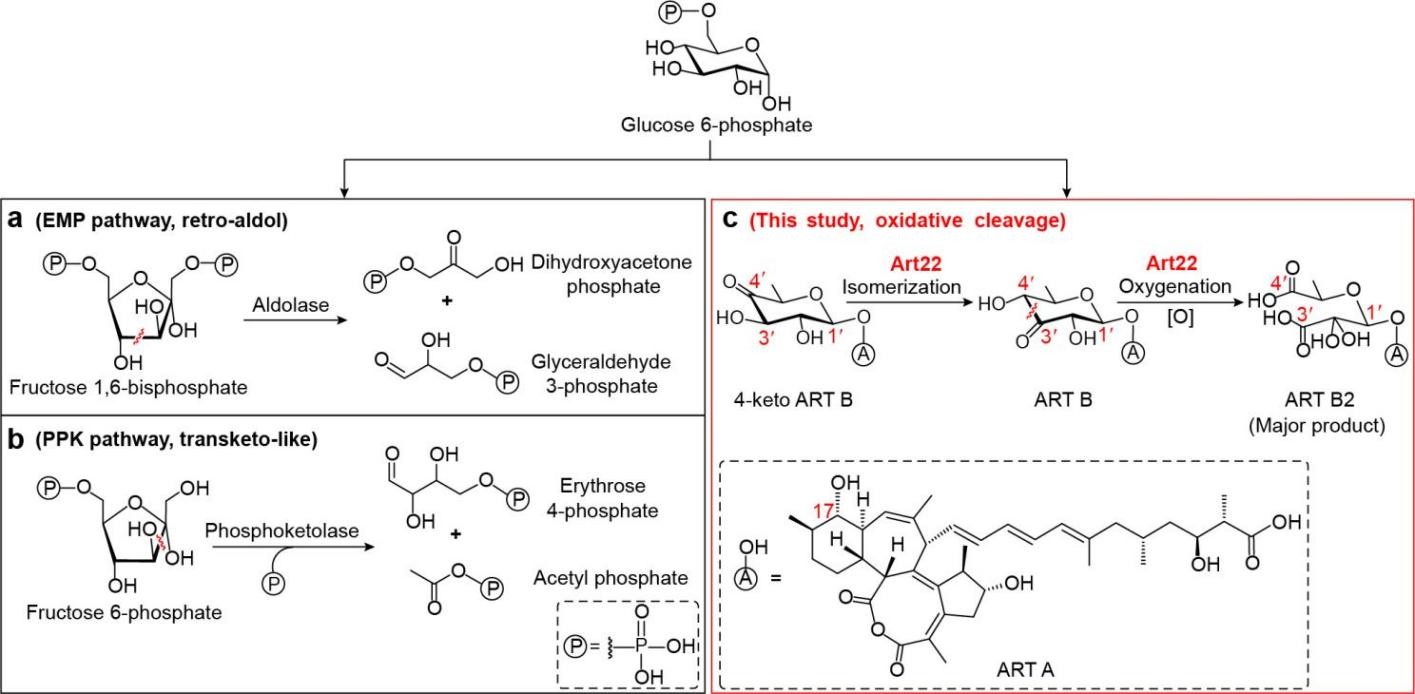
图1 酶催化己糖碳碳键断裂的不同方式
环烯酸菌素是一类具有独特6/7/8/5四环结构的多烯聚酮类天然产物,对革兰氏阳性菌表现出显著的抗菌活性。本研究中,研究团队发现金属异构酶Art22具有典型的 TIM (triosephosphate isomerase)桶状结构,其不仅能催化己酮糖的异构化反应,还能依赖过渡金属离子活化氧气,通过酸酐中间体实现己糖的氧化断裂并伴随CO2的释放。更为独特的是,Art22能在同一催化中心依次完成异构化与氧化裂解两步反应,并在细菌内发挥双重生理功能:一方面通过异构化促进杀菌活性分子的生成,另一方面通过氧化裂解作用使微量毒性产物失活,从而实现“进攻”与“防御”的动态平衡(图2)。该研究不仅系统阐明了一种全新的糖类氧化裂解机制,拓展了TIM-桶金属酶的催化反应谱系,还揭示了微生物利用同一酶的多重催化活性实现生理功能智能化调控的分子策略。
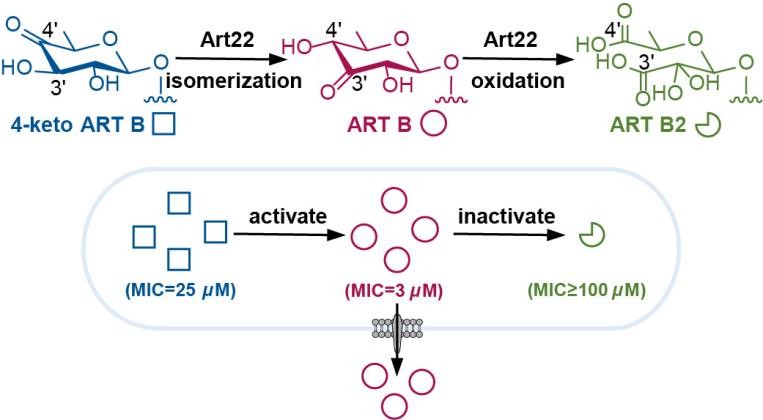
图2 金属酶Art22催化己糖的异构和氧化裂解并发挥抗生素激活与解毒功能
中国科学院微生物研究所副研究员李鹏伟、特别研究助理王大成、助理研究员郭路以及厦门大学的博士研究生陈艳茹为该论文的共同第一作者。该研究获得国家重点研发计划、国家自然科学基金、中国科学院青年创新促进会以及中国科学院战略性先导科技专项等项目的支持。
原文链接:https://www.nature.com/articles/s41929-025-01412-8




