细胞内免疫受体NLRs是动植物先天免疫的核心组成成分。在动物中,NLRs通过组装炎症小体来激活caspase蛋白酶,进而切割活化促炎细胞因子,引发炎症反应。植物虽然不编码caspase蛋白酶,但拥有在结构和功能上与之类似的蛋白酶metacaspases (MCs)。然而,MCs在植物免疫中的作用机制,及其与NLR信号通路的互作与调控关系仍不清楚。
近日,中国科学院微生物研究所叶健团队在Nature Communications上发表题为“Cleavage of Bcl-2-associated athanogene by metacaspase determines plant antiviral immunity”的研究论文,首次揭示了在高等植物中,metacaspase 4(MC4)蛋白酶能够特异识别并精确切割Bcl-2-associated athanogene 3(BAG3),切割过程诱导植物细胞程序性死亡,进而启动植物抗病毒免疫反应。这一发现不仅深化了对动植物趋同免疫进化机制的理解,也为培育具有抗病毒能力的作物提供了新的分子靶点。
双生病毒作为植物病毒中种类最庞大的类群,可侵染番茄、棉花、玉米、大豆、木薯和小麦等重要粮食和经济作物,每年在全球范围内造成数十亿美元经济损失,对粮食安全和生物安全构成持续威胁。由于缺乏抗病基因,且对抗病免疫机制认知不足,尚缺乏绿色高效的防控手段。研究团队发现,MC4在感知双生病毒侵染后表达水平被显著诱导上调,MC4自激活后介导BAG3蛋白在第122位精氨酸处发生切割,释放BAG3的N端功能结构域(BAG3-N),从而解除BAG3的自抑制状态。BAG3-N进而发生多聚化,形成多聚体并定位至细胞膜,最终引发细胞死亡,从而有效抑制病毒的复制与增殖。进一步机制研究发现,在茄科植物中,辅助型免疫受体(Helper NLRs)NRC2和NRC3 还可以同MC4-BAG3免疫模块发生互作,严谨调控植物胞内免疫。值得关注的是,在植物从低等类群向高等植物(裸子和被子植物)的进化过程中,BAG3蛋白第50位氨基酸被逐渐选择稳定保留为对其多聚体化至关重要的赖氨酸,赋予了BAG3诱导细胞死亡的能力,成为其抗病毒功能的重要分子基础。另一方面,双生病毒中最保守的复制相关蛋白Rep可特异性结合BAG3-N,进而实现免疫逃逸,增强其在宿主细胞内的存活能力与感染进程。
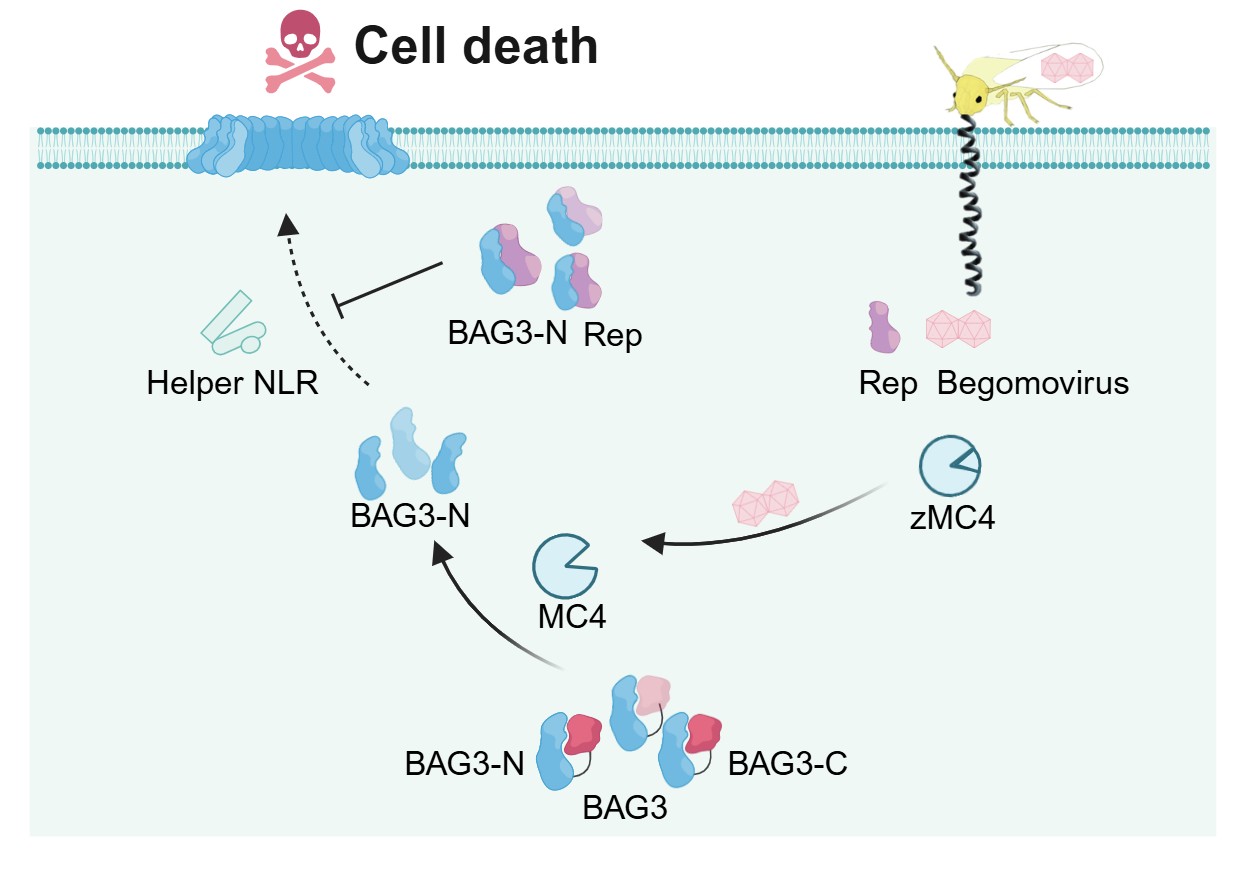
综上,本研究发现了高等植物中BAG3是衔接上游metacaspase 激活与下游抗病毒防御的保守免疫调控因子,为抗病作物的分子设计与培育提供了新策略和新的分子靶标。
中国科学院微生物研究所博士研究生梁琳和蒋宇航为该文章的共同第一作者,叶健研究员为文章通讯作者。该研究得到国家杰出青年科学基金项目,国家重点研发计划及中国科学院项目的经费支持。
原文链接:https://doi.org/10.1038/s41467-025-64021-w




