
- 高级人才招聘
- 中、初级专业技术人才招聘
- 管理、支撑岗位招聘
- 博士后招聘
近日,中国科学院微生物研究所周珊珊研究团队在Nature Communications 发表了题为“Trifunctional flavoenzyme-catalyzed asymmetric 4-alkyl-butenolide assembly in avenolide biosynthesis”的研究论文。该研究系统解析了阿维链霉菌中调控重要抗寄生虫药物阿维菌素生成的信号分子——阿维内酯(avenolide)的生物合成途径,深化了对链霉菌4-烷基丁烯内酯类信号分子合成机制的认识。同时,团队还鉴定出一类可一步催化构建4-烷基丁烯内酯骨架的黄素酶,为高效制备手性4-烷基丁烯内酯结构单元提供了重要的酶学工具。
含有γ-丁烯内酯结构或由该结构衍生而来的信号分子普遍存在于链霉菌和相关放线菌中。这类分子通过与特定的转录抑制因子结合,调控链霉菌形态分化和次级代谢产物的合成。阿维链霉菌(Streptomyces avermitilis)是一种革兰氏阳性土壤放线菌,因其能合成在农业、兽医和公共卫生领域重要的抗寄生虫药物——阿维菌素而闻名。其中,阿维内酯作为链霉菌中首个发现的4-烷基丁烯内酯类信号分子,能够调控阿维链霉菌中阿维菌素的生物合成。然而,尽管前期研究表明其生物合成途径可能由酰基辅酶A氧化酶(SavA)和细胞色素P450酶(SavB)共同参与,但具体的酶学功能与催化机制尚不明确。
本研究中,团队通过异源表达、化学合成和体外酶促反应等多种手段,解析了信号分子阿维内酯的生物合成途径(图1)。结果表明,黄素酶SavA可以利用脂肪酸代谢途径中长链脂肪酰基辅酶A(acyl CoA)或长链脂肪酰基载脂蛋白(acyl ACP)为底物,催化连续的α,β-顺式脱氢、γ-羟化以及分子内关环反应,一步合成(4S)-4-烷基丁烯内酯核心骨架。随后, SavB依次催化C-9、C-10位的氧化,最终完成阿维内酯的生物合成。其中,SavA具备酰基辅酶A氧化酶和黄素依赖单加氧酶的双重催化特性。通过同位素标记和定点突变实验,研究推测其催化机制涉及顺式脱氢中间体捕获形成的活性C4a-hydroperoxide FAD, 进而推动氧原子转移并实现FADox的循环再生(图2)。该酶仅以氧气作为氧化剂,在不依赖外源辅酶或NAD(P)H的条件下即可实现单酶催化,展现出优异的原子经济性和催化效率,为高效构建含手性4-烷基丁烯内酯结构单元的药用分子及高附加值化合物提供了新颖的生物催化策略。
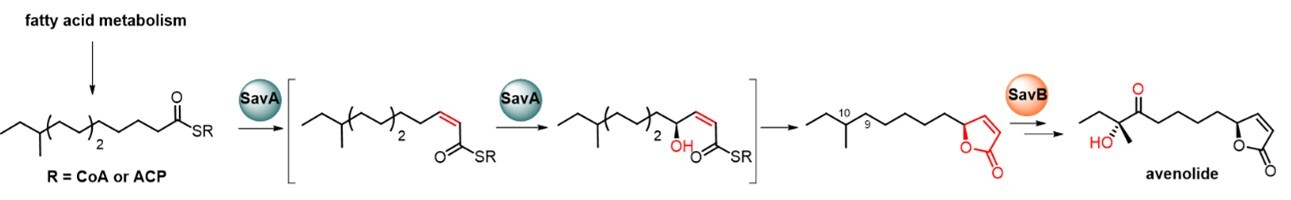
图1. Avenolide的生物合成途径
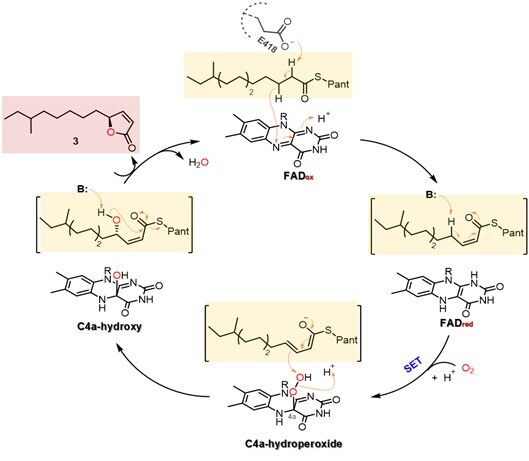
图2. 推测的SavA催化生成手性4-烷基丁烯内酯的反应机制
中国科学院微生物研究所博士研究生李文睿和赵金莲博士为该论文的共同第一作者,周珊珊研究员为文章通讯作者。该研究得到国家重点研发计划、中国科学院战略性先导科技专项和国家自然科学基金等项目的资助。
原文链接:https://www.nature.com/articles/s41467-026-69265-8
附件下载: